Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Kémia, gázelegyek IV.
 mendhann
{ Elismert } kérdése
mendhann
{ Elismert } kérdése
632
Elektromos ívkemencében 500 m3 normálállapotú metánból olyan gázelegyet kaptak, amely 12 V/V% acetilént,10V/V% metánt és 78 V/V% hidrogén tartalmazott.
Határozzuk meg:
a, a reakciótérből távozó gázok térfogatát normálállapotban.
b, mekkora térfogatú metán alakult acetilénné.
c, mekkora térfogatú metán bomlott elemeire.
d, mekkora tömegű gázkorom rakodott a le berendezésben.
Határozzuk meg:
a, a reakciótérből távozó gázok térfogatát normálállapotban.
b, mekkora térfogatú metán alakult acetilénné.
c, mekkora térfogatú metán bomlott elemeire.
d, mekkora tömegű gázkorom rakodott a le berendezésben.
Jelenleg 1 felhasználó nézi ezt a kérdést.
0
Középiskola / Kémia
Válaszok
1 kazah
megoldása
kazah
megoldása
Egyenletrendezés:
Először sztöchiometriailag rendezzük paraméteresen:
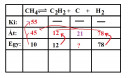
(x+2y) `overset(-4 +1)(CH_4)` `Leftrightarrow` x `overset(0)(C)` + y `overset(-1 +1)(C_2H_2)` + (2x+3y) `overset(0)(H_2)`
Ezután elektronátmenet szempontjából írjuk fel az egyenletet (matematikai egyenletet); elektronszám-csökkenés = elektronszám-növekedés:
4x + 6y = 2(2x+3y)
Ez egy szép azonosság lett, de nekünk ez csak jó, mert így a keletkezett termékekkel szabadon lehet számolni.
Az ábra egyensúlyi sora tartalmazza a megadott százalékokat. Ezt most vegyünk 100-nak, akár `m^3`-ben, akár molban. Majd a konkrét mennyiségekre később vonatkoztatjuk.
Amennyi van egyensúlyban az acetilénből és a hidrogénből (ez lesz a 12 és 78 mol), ugyanannyi alakult át, hiszen a kiindulási elegyben (nem is igazán elegy, mert csak metán van benne) nem volt. Ebből ki tudjuk számolni az átalakult metán mennyiségét (78 `H_2` és 12 `H_2` az 90 `H_2`, ami 45 "`H_4`"-nek felel meg). A korom mennyisége is könnyen számolható: 45 C-ből 12 "`C_2`" megy el az acetilénre, a többi (45-(2*12) =) 21 C lesz a korom.
a,
55 mol metánból keletkezik 12 mol acetilén
500 `m^3` metánból keletkezik `500/55*12` = `color(red)(109.1)` `color(red)(m^3)` `color(red)(acetilén)`
55 mol metánból keletkezik 78 mol hidrogén
500 `m^3` metánból keletkezik `500/55*78` = `color(red)(709.1)` `color(red)(m^3)` `color(red)(hidrogén)`
55 mol metánból marad 10 mol metán
500 `m^3` metánból marad `500/55*10` = `color(red)(90,9)` `color(red)(m^3)` `color(red)(metán)`
c, Ezt előrehoztam, mert ez egyértelműbb:
Amennyi korom (C) keletkezik, annyi metán bomlott elemeire (Ennek az egyenlete: `CH_4` `rArr` C + 2 `H_2` )
55 mol metánból 21 mol bomlott elemeire
500 `m^3` metánból `500/55*21` = `color(red)(190.9)` `color(red)(m^3)` `color(red)("metán bomlott elemeire")`.
b, A többi mol (45-21=)24 mol metán alakult acetilénné.
55 mol metánból 24 mol alakult acetilénné.
500 `m^3` metánból `500/55*24` = `color(red)(218.2)` `color(red)(m^3)` `color(red)("metán alakult acetilénné")`.
d,
Ehhez már ki kell számolnunk a konkrét mennyiséget:
500 `m^3` metán az `500/22.41` = 22,311 kmol metán, ennyiből indultunk ki.
55 mol metánból keletkezik 21 mol C
22,311 kmol metánból keletkezik `22.311/55*21` = 8,52 kmol C; ami `8.52*12` = `color(red)("102.23 kg korom rakódik le a berendezésben")`.
Először sztöchiometriailag rendezzük paraméteresen:
(x+2y) `overset(-4 +1)(CH_4)` `Leftrightarrow` x `overset(0)(C)` + y `overset(-1 +1)(C_2H_2)` + (2x+3y) `overset(0)(H_2)`
Ezután elektronátmenet szempontjából írjuk fel az egyenletet (matematikai egyenletet); elektronszám-csökkenés = elektronszám-növekedés:
4x + 6y = 2(2x+3y)
Ez egy szép azonosság lett, de nekünk ez csak jó, mert így a keletkezett termékekkel szabadon lehet számolni.
Az ábra egyensúlyi sora tartalmazza a megadott százalékokat. Ezt most vegyünk 100-nak, akár `m^3`-ben, akár molban. Majd a konkrét mennyiségekre később vonatkoztatjuk.
Amennyi van egyensúlyban az acetilénből és a hidrogénből (ez lesz a 12 és 78 mol), ugyanannyi alakult át, hiszen a kiindulási elegyben (nem is igazán elegy, mert csak metán van benne) nem volt. Ebből ki tudjuk számolni az átalakult metán mennyiségét (78 `H_2` és 12 `H_2` az 90 `H_2`, ami 45 "`H_4`"-nek felel meg). A korom mennyisége is könnyen számolható: 45 C-ből 12 "`C_2`" megy el az acetilénre, a többi (45-(2*12) =) 21 C lesz a korom.
a,
55 mol metánból keletkezik 12 mol acetilén
500 `m^3` metánból keletkezik `500/55*12` = `color(red)(109.1)` `color(red)(m^3)` `color(red)(acetilén)`
55 mol metánból keletkezik 78 mol hidrogén
500 `m^3` metánból keletkezik `500/55*78` = `color(red)(709.1)` `color(red)(m^3)` `color(red)(hidrogén)`
55 mol metánból marad 10 mol metán
500 `m^3` metánból marad `500/55*10` = `color(red)(90,9)` `color(red)(m^3)` `color(red)(metán)`
c, Ezt előrehoztam, mert ez egyértelműbb:
Amennyi korom (C) keletkezik, annyi metán bomlott elemeire (Ennek az egyenlete: `CH_4` `rArr` C + 2 `H_2` )
55 mol metánból 21 mol bomlott elemeire
500 `m^3` metánból `500/55*21` = `color(red)(190.9)` `color(red)(m^3)` `color(red)("metán bomlott elemeire")`.
b, A többi mol (45-21=)24 mol metán alakult acetilénné.
55 mol metánból 24 mol alakult acetilénné.
500 `m^3` metánból `500/55*24` = `color(red)(218.2)` `color(red)(m^3)` `color(red)("metán alakult acetilénné")`.
d,
Ehhez már ki kell számolnunk a konkrét mennyiséget:
500 `m^3` metán az `500/22.41` = 22,311 kmol metán, ennyiből indultunk ki.
55 mol metánból keletkezik 21 mol C
22,311 kmol metánból keletkezik `22.311/55*21` = 8,52 kmol C; ami `8.52*12` = `color(red)("102.23 kg korom rakódik le a berendezésben")`.
2
-
mendhann: Nagyon szépen köszönöm a részletes választ!
 )
5 éve
0
)
5 éve
0