Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Kémia
 panczelluca
kérdése
panczelluca
kérdése
650
Ezt akét feladatot meg tudnátok oldani?
Előre is köszönöm!

Előre is köszönöm!
Jelenleg 1 felhasználó nézi ezt a kérdést.
0
Középiskola / Kémia
Válaszok
2 Neoporteria11
{ Vegyész }
megoldása
Neoporteria11
{ Vegyész }
megoldása
Szia!
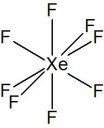
XF8 molekula nem létezik, egyedül a XeF8 kétszeresen negatív iont találtam, de szerintem erre gondoltak.
A szerkezeti képleteket majd képként csatolom.
XeF82-:
Alak: csonkolt ikozaéder
Kötésszög: ~60 °
Polaritás: Apoláris
Kov. vegyérték: 8
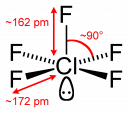
ClF5:
Alak: tetragonális piramis (négyszögalapú piramis)
Kötésszög: 90
Polaritás: Poláris
Kov. vegyérték: 5
XF8 molekula nem létezik, egyedül a XeF8 kétszeresen negatív iont találtam, de szerintem erre gondoltak.
A szerkezeti képleteket majd képként csatolom.
XeF82-:
Alak: csonkolt ikozaéder
Kötésszög: ~60 °
Polaritás: Apoláris
Kov. vegyérték: 8
ClF5:
Alak: tetragonális piramis (négyszögalapú piramis)
Kötésszög: 90
Polaritás: Poláris
Kov. vegyérték: 5
1
- Még nem érkezett komment!
 Neoporteria11
{ Vegyész }
válasza
Neoporteria11
{ Vegyész }
válasza
Ha kétvegyértékű fémről van szó, akkor a kloridja MeCl2 képlettel írható fel (Me az ismeretlen fém).
Vegyünk képzeletben ebből a vegyületből 100 g-ot. Ebben 47,21 g ismeretlen fém és kizárásos alapon 100-47,21=52,79 g klór van. Mivel azonban a klór atomtömege 35,5 g/mol, ezért ennyi klór anyagmennyisége 52,79/35,5=1,487 mol. Ekkor viszont a fémének ennek felének kell lennie, azaz belőle 1,487/2=0,7435 mol található. Mivel ismerjük a tömegét is, meghatározható az atomtömege: 47,21/0,7435=63,5 g/mol. Ez pedig a réz lesz, így a vegyület a réz-klorid, CuCl2.
Na, vegyünk ismét 100 g-ot, csak most az oldatból. Ebben található 13,1 g réz-klorid, a fennmaradó 100-13,1=86,9 g mind víz. Csak egy része az oldásra felhasznált víz, míg a másik része eleve benne volt kristályvízként.
Ha jobban elgondolkodunk, 1 rész cucchoz 5 rész vizet adtak, így a 100g oldat tulajdonképpen 6 rész anyagból áll, melyből egy rész a kristályvizes só. Így ennek a tömege 100/6×1=16,66 g. Ez nyilván több, mint a 13,1, mivel van benne víz is. Mégpedig 16,66-13,1=3,56 g.
Ennyi víz pedig 3,56/18=0,1977 mol, míg 13,1g CuCl2 (moláris tömege 134,5 g/mol) 13,1/134,5=0,0974 mol. Így a kettő aránya: CuCl2:H2O=0,0974:0,1977=1:2.
Azaz a kristályvizes só képlete CuCl2×2H2O
Vegyünk képzeletben ebből a vegyületből 100 g-ot. Ebben 47,21 g ismeretlen fém és kizárásos alapon 100-47,21=52,79 g klór van. Mivel azonban a klór atomtömege 35,5 g/mol, ezért ennyi klór anyagmennyisége 52,79/35,5=1,487 mol. Ekkor viszont a fémének ennek felének kell lennie, azaz belőle 1,487/2=0,7435 mol található. Mivel ismerjük a tömegét is, meghatározható az atomtömege: 47,21/0,7435=63,5 g/mol. Ez pedig a réz lesz, így a vegyület a réz-klorid, CuCl2.
Na, vegyünk ismét 100 g-ot, csak most az oldatból. Ebben található 13,1 g réz-klorid, a fennmaradó 100-13,1=86,9 g mind víz. Csak egy része az oldásra felhasznált víz, míg a másik része eleve benne volt kristályvízként.
Ha jobban elgondolkodunk, 1 rész cucchoz 5 rész vizet adtak, így a 100g oldat tulajdonképpen 6 rész anyagból áll, melyből egy rész a kristályvizes só. Így ennek a tömege 100/6×1=16,66 g. Ez nyilván több, mint a 13,1, mivel van benne víz is. Mégpedig 16,66-13,1=3,56 g.
Ennyi víz pedig 3,56/18=0,1977 mol, míg 13,1g CuCl2 (moláris tömege 134,5 g/mol) 13,1/134,5=0,0974 mol. Így a kettő aránya: CuCl2:H2O=0,0974:0,1977=1:2.
Azaz a kristályvizes só képlete CuCl2×2H2O
1
- Még nem érkezett komment!