Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Kémia: 10.osztály
 Kaktusz123
kérdése
Kaktusz123
kérdése
485
Sziasztok!
Ezekben a számítási feladatokban kéne egy kis segítség. A feladatokat csatolom.
Ezekben a számítási feladatokban kéne egy kis segítség. A feladatokat csatolom.
Jelenleg 1 felhasználó nézi ezt a kérdést.
0
Középiskola / Kémia
Válaszok
1 kazah
megoldása
kazah
megoldása
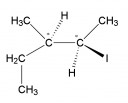
A vegyület összegképlete `C_xH_yCl`
A vegyületnek két kiralitáscentruma van, akkor egyszer van két szénatom, ami
a kiralitáscentrum, aztán az egyik királis szénatomhoz kapcsolódik a másik
királis szénatom, egy hidrogén, egy metil és egy etilcsoport (ez +3
szénatom); a másik királis szénatomhoz kapcsolódik az egyik királis
szénatom, a halogén, egy hidrogén és pl egy metilcsoport. Ez eddig 6
szénatom (minimum). Ha NaOH-dal reagáltatjuk, akkor a halogén lecserélődik
hidroxilcsoportra, a keletkezett szervetlen vegyület a nátrium-halogenid, ez
klórgázzal adja a barnás színreakciót, ami barna színű lesz. A halogenid
tehát a jodid. A keletkező jód lesz a széntetrakloridban ibolya színű.
100 g vegyületben van 59,9 g jód
Hány g vegyületben van 126,9 g jód.
? = `127/59.9*100` = 212 g ; ennyi a vegyület moláris tömege.
Ebből levonva a jód moláris tömegét, a szénre és hidrogénre marad 85 g.
Ebből megállapíthatjuk, hogy a vegyület összegképlete: `C_6H_(13)I`.
Rajz mellékelve.
3,
A szénhidrogén
100 g-jában van 87,8 g szén, ami `87.8/12` = 7,317 mol szén és
100-87,8 = 12,2 g hidrogén, ami 12,2 mol hidrogén
A mólarány C:H = 7,317:12,2 = 0,6:1 = 6:10
A legegyszerűbb eset, ha a vegyület a `C_3H_5`, ilyen vegyület azonban nincs.
A keresett szénhidrogén: `C_6H_10`
Ha egy kettős kötést tartalmaz a vegyület, akkor
`C_6H_(10)` + `Br_2` `Rightarrow` `C_6H_(10)Br_2`
`M_(Br_2)` = 160 `g/(mol)`
Az olefin 1 g-ja addícionál 1,95 g brómot.
Mennyi addícionál 160 g brómot? (1 mól brómot, ugyanis azt 1 mol olefin addícionál).
x = `160/1.95` = 82 `g/(mol)`
`M_(C_6H_(10))` = 82 `g/(mol)`
A vegyület összegképletét ismerjük, illetve azt is megtudtuk, hogy 1 db kettős kötést tartalmaz.
4,
`C_nH_(2n)` + HI `Rightarrow` `C_nH_(2n+1)I`
12n+2n g olefinből keletkezik 12n+2n+1+127 g jodid
100 g olefinből keletkezik 230,5 g jodid
`(14n)/100` = `(14n+128)/230.5`
n = 7
A keresett olefin a hexén (`C_7H_(14)`).
5,
`CH_4` + 3 `Cl_2` = `CHCl_3` + 3 `HCl`
A reakcióhőt úgy tudjuk kiszámolni, ha a kiindulási anyagok kötési energiájának összegéből kivonjuk a keletkezett anyagok kötési energiájának összegét:
`DeltaH_r` = `∑E_("k.kiindulási")` - `∑E_("k.keletkező")`
`DeltaH_r` = `(4*(C-H)+3*(Cl-Cl))`-`(3*(C-Cl)+(C-H)+3*(H-Cl))` = `((4*414)+(3*243))` - `((3*328)+(414)+(3*432))` = 2385 - 2694 = -309 `(kJ)/(mol)`.
6,
`C_2H_4` + `Br_2` `Rightarrow` `C_2H_4Br_2`
`M_(Br_2)` = 160 `g/(mol)`
6 `dm^3` elegyben van 30% etén, ami `6*0.3` = 1,8 `dm^3` etén
1 mol etén térfogata 24,5 `dm^3`
hány mol etén térfogata 1,8 `dm^3`?
x = `1.8/24.5` = 0,0735 mol; ugyanennyi mol brómot addícionál, ami `0.0735*160` = 11,755 g
11,755 g brómot addícionál a gázelegy.
7,
`C_6H_6` + `Br_2` `Rightarrow` `C_6H_5Br` + HBr
`M_(C_6H_6)` = 78 `g/(mol)`
`M_(Br_2)` = 160 `g/(mol)`
50 `cm^3` benzol tömege m = `rho_b*V_b` = `50*0.88` = 44 g. Ez `44/78`= 0,564 mol. Ugyanennyi mol brómmal reagál. 0,564 mol bróm tömege `0.564*160` = 90,26 g. Ennek a térfogata:
`V_(Br_2)` = `m_(Br_2)/rho_(Br_2)` = `90.26/3.12` = 28,93 `cm^3`
0
- Még nem érkezett komment!