Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Carnot ciklus
 Shaz
kérdése
Shaz
kérdése
603
Mekkora a teljes belső energia változás?
A és B között mekkora a munkavégzés?
Nincsenek konkrét számok, képletek, levezetés szükséges.
A és B között mekkora a munkavégzés?
Nincsenek konkrét számok, képletek, levezetés szükséges.
Jelenleg 1 felhasználó nézi ezt a kérdést.
0
Felsőoktatás / Fizika
Válaszok
2 gyula205
megoldása
gyula205
megoldása
Mivel `A rightarrow B` esetén izoterm folyamatról van szó, akkor
`W_(AB)=-frac{m}{M}RT_A*ln(frac{V_B}{V_A})` valamint `U_(AB)=Delta U=0`.
Továbbá `B rightarrow C` esetén `U_(BC)=-Delta U=-W_(BC)`, mert
itt adiabatikus a folyamat;
`C rightarrow D` esetén `U_(CD)=Delta U=0`, megint izotermáról beszélünk;
végül `C rightarrow D` esetén `U_(DA)=+Delta U=W_(DA)` megint adiabata.
Így a teljes belső energia megváltozás zérus.
Lásd még: en.wikipedia.org/wiki/Carnot_cycle
hu.wikipedia.org/wiki/Carnot-ciklus
`W_(AB)=-frac{m}{M}RT_A*ln(frac{V_B}{V_A})` valamint `U_(AB)=Delta U=0`.
Továbbá `B rightarrow C` esetén `U_(BC)=-Delta U=-W_(BC)`, mert
itt adiabatikus a folyamat;
`C rightarrow D` esetén `U_(CD)=Delta U=0`, megint izotermáról beszélünk;
végül `C rightarrow D` esetén `U_(DA)=+Delta U=W_(DA)` megint adiabata.
Így a teljes belső energia megváltozás zérus.
Lásd még: en.wikipedia.org/wiki/Carnot_cycle
hu.wikipedia.org/wiki/Carnot-ciklus
Módosítva: 6 éve
0
- Még nem érkezett komment!
 gyula205
válasza
gyula205
válasza
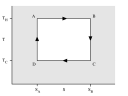
`T_H=T_1=T_2`; `T_C=T_3=T_4`.
(H-hot; C-cold)
(szokták még alkalmazni `Q_(fel)=Q_1` ill. `Q_(text(le))=Q_2` jelöléseket is)
`Q_1=W_(AB)`
és mivel `Q_1-Q_2=W_(AB)-W_(CD)-W_(DA)+W_(BC)=W`
ahol `W` a rendszer munkája.
Ezért `Q_2=W_(CD)+W_(DA)-W_(BC)`
Természetesen `Q_1 gt Q_2` .
Ebből a hatásfok `eta=frac{W}{Q_1}=frac{Q_1-Q_2}{Q_1}`,
azt mutatja meg, hogy a forró hőtartályból felvett hő hányadrészét alakítják munkává.
Tudjuk, hogy állandó nyomáson a dugattyúra állandó
`F=p*A` erővel kell hatni. A végzett munka `W=pA*s` és az egyik geometriai összefüggés
alapján `W=-p*Delta V`,
itt figyelembe vettük az előjelválasztást. Ábrázolva a nyomást a térfogat függvényében
felírhatunk egy integrálközelítő összeget a munkára:
`p_1*frac{Delta V}{n}+p_2*frac{DeltaV}{n}+...+p_n*frac{DeltaV}{n}`
Ennek határértéke `W=-int_(V_1)^(V_2) p(V) dV` térfogati integrál.
Állandó hőmérsékleten az egyesített gáztörvényből
`p(V)=frac{p_1*V_1}{V}` függvényt integrálva a megadott tartományon,
kapjuk az izoterm munkát `W=-frac{m}{M}*R*T_C*ln(frac{V_2}{V_1})`.
Teljesen hőszigetelt rendszerben a nyomás az adiabata egyenlete alapján számítható:
Vegyük fel a `p(V)=p_1*(frac{V_1}{V})^(kappa)` függvényt és integráljunk
a megadott tartományon. Eredményünk `W=frac{p_1*V_1-p_2*V_2}{1-kappa}` lesz.
Kiegészítésül az érintett folyamatokra igaz lesz még:
`A rightarrow B` esetén `Q_(AB)=Q_1`,
`B rightarrow C` esetén `Q_(BC)=0` és a fenti adibata munkaképletet
alkalmazva `W_(BC)=frac{p_C*V_C-p_B*V_B}{kappa-1}`
továbbá `C rightarrow D` esetén `Q_(CD)=-Q_2` és fenti izoterm munka
képletet alkalmazva
`W_(CD)=-frac{m}{M}*R*T_C*ln(frac{V_D}{V_C})`.
Befejezésül `D rightarrow A` esetén `Q_(DA)=0` és
`W_(DA)=frac{p_A*V_A-p_D*V_D}{kappa-1}`.
(Megjegyzés: A sárga függvénytáblázat egyes kiadásainál a Carnot-körfolyamat
leírásánál olyan elírás vehető észre, ahol fordítva szerepel a hőmérséklet indexe
és e miatt negatív hatásfokot kapnánk.
Természetesen minden esetben a hatásfok nemnegatív értéket vehet fel.)
Ideális gázzal működő Carnot-féle körfolyamat hatásfoka:
`eta_(id)=1-frac{T_2}{T_1}` .
Bizonyítás:
Felhasználva, hogy `p_A*V_A+p_C*V_C=p_B*V_B+p_D*V_D` azonosságot
és az izotermikus folyamat alatt végzett munkák hányadosa
`frac{W_(CD)}{W_(AB)}=frac{Q_2}{Q_1}=frac{Q_(text(le))}{Q_(fel)}=`
`=-frac{frac{m}{M}*R*T_2*ln(frac{V_D}{V_C})}{frac{m}{M}*R*T_1*ln(frac{V_B}{V_A})}`.
Továbbá felhasználva az adiabatákra vonatkozó egyenleteket
`T_1*V_B^(kappa-1)=T_2*V_C^(kappa-1)`
`T_1*V_A^(kappa-1)=T_2*V_D^(kappa-1)`
elosztva a kétegyenletet egymással és `(kappa-1)`-edik gyököt vonva kapjuk, hogy
`frac{V_D}{V_C}=frac{V_A}{V_B}`
Ezt viszzahelyettesítve a fenti logaritmusos egyenletbe kapjuk az ideális gázokra
vonatkozó `eta_(id)` hatásfokot.
Végezetül néhány gondolat az entrópiáról.
`frac{Q_1}{T_1}+frac{Q_2}{T_2}=frac{W_(AB)}{T_1}+frac{W_(CD)}{T_2}=`
`=frac{m*R}{M}*(frac{T_A}{T_1}*ln(frac{V_B}{V_A})+frac{T_C}{T_2}*ln(frac{V_D}{V_C}))=`
`=frac{m*R}{M}*ln(frac{V_B*V_D}{V_A*V_C})=0`.
vagyis a Carnot-körfolyamat esetén a redukált hőmennyiségek vagy entrópiák
összege zérus: `S_1+S_2=0`, ahol `S_1=frac{Q_1}{T_1}` ill. `S_2=frac{Q_2}{T_2}`.
(H-hot; C-cold)
(szokták még alkalmazni `Q_(fel)=Q_1` ill. `Q_(text(le))=Q_2` jelöléseket is)
`Q_1=W_(AB)`
és mivel `Q_1-Q_2=W_(AB)-W_(CD)-W_(DA)+W_(BC)=W`
ahol `W` a rendszer munkája.
Ezért `Q_2=W_(CD)+W_(DA)-W_(BC)`
Természetesen `Q_1 gt Q_2` .
Ebből a hatásfok `eta=frac{W}{Q_1}=frac{Q_1-Q_2}{Q_1}`,
azt mutatja meg, hogy a forró hőtartályból felvett hő hányadrészét alakítják munkává.
Tudjuk, hogy állandó nyomáson a dugattyúra állandó
`F=p*A` erővel kell hatni. A végzett munka `W=pA*s` és az egyik geometriai összefüggés
alapján `W=-p*Delta V`,
itt figyelembe vettük az előjelválasztást. Ábrázolva a nyomást a térfogat függvényében
felírhatunk egy integrálközelítő összeget a munkára:
`p_1*frac{Delta V}{n}+p_2*frac{DeltaV}{n}+...+p_n*frac{DeltaV}{n}`
Ennek határértéke `W=-int_(V_1)^(V_2) p(V) dV` térfogati integrál.
Állandó hőmérsékleten az egyesített gáztörvényből
`p(V)=frac{p_1*V_1}{V}` függvényt integrálva a megadott tartományon,
kapjuk az izoterm munkát `W=-frac{m}{M}*R*T_C*ln(frac{V_2}{V_1})`.
Teljesen hőszigetelt rendszerben a nyomás az adiabata egyenlete alapján számítható:
Vegyük fel a `p(V)=p_1*(frac{V_1}{V})^(kappa)` függvényt és integráljunk
a megadott tartományon. Eredményünk `W=frac{p_1*V_1-p_2*V_2}{1-kappa}` lesz.
Kiegészítésül az érintett folyamatokra igaz lesz még:
`A rightarrow B` esetén `Q_(AB)=Q_1`,
`B rightarrow C` esetén `Q_(BC)=0` és a fenti adibata munkaképletet
alkalmazva `W_(BC)=frac{p_C*V_C-p_B*V_B}{kappa-1}`
továbbá `C rightarrow D` esetén `Q_(CD)=-Q_2` és fenti izoterm munka
képletet alkalmazva
`W_(CD)=-frac{m}{M}*R*T_C*ln(frac{V_D}{V_C})`.
Befejezésül `D rightarrow A` esetén `Q_(DA)=0` és
`W_(DA)=frac{p_A*V_A-p_D*V_D}{kappa-1}`.
(Megjegyzés: A sárga függvénytáblázat egyes kiadásainál a Carnot-körfolyamat
leírásánál olyan elírás vehető észre, ahol fordítva szerepel a hőmérséklet indexe
és e miatt negatív hatásfokot kapnánk.
Természetesen minden esetben a hatásfok nemnegatív értéket vehet fel.)
Ideális gázzal működő Carnot-féle körfolyamat hatásfoka:
`eta_(id)=1-frac{T_2}{T_1}` .
Bizonyítás:
Felhasználva, hogy `p_A*V_A+p_C*V_C=p_B*V_B+p_D*V_D` azonosságot
és az izotermikus folyamat alatt végzett munkák hányadosa
`frac{W_(CD)}{W_(AB)}=frac{Q_2}{Q_1}=frac{Q_(text(le))}{Q_(fel)}=`
`=-frac{frac{m}{M}*R*T_2*ln(frac{V_D}{V_C})}{frac{m}{M}*R*T_1*ln(frac{V_B}{V_A})}`.
Továbbá felhasználva az adiabatákra vonatkozó egyenleteket
`T_1*V_B^(kappa-1)=T_2*V_C^(kappa-1)`
`T_1*V_A^(kappa-1)=T_2*V_D^(kappa-1)`
elosztva a kétegyenletet egymással és `(kappa-1)`-edik gyököt vonva kapjuk, hogy
`frac{V_D}{V_C}=frac{V_A}{V_B}`
Ezt viszzahelyettesítve a fenti logaritmusos egyenletbe kapjuk az ideális gázokra
vonatkozó `eta_(id)` hatásfokot.
Végezetül néhány gondolat az entrópiáról.
`frac{Q_1}{T_1}+frac{Q_2}{T_2}=frac{W_(AB)}{T_1}+frac{W_(CD)}{T_2}=`
`=frac{m*R}{M}*(frac{T_A}{T_1}*ln(frac{V_B}{V_A})+frac{T_C}{T_2}*ln(frac{V_D}{V_C}))=`
`=frac{m*R}{M}*ln(frac{V_B*V_D}{V_A*V_C})=0`.
vagyis a Carnot-körfolyamat esetén a redukált hőmennyiségek vagy entrópiák
összege zérus: `S_1+S_2=0`, ahol `S_1=frac{Q_1}{T_1}` ill. `S_2=frac{Q_2}{T_2}`.
Módosítva: 6 éve
0
- Még nem érkezett komment!