Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Kémia 10.osztály
 Kormi
kérdése
Kormi
kérdése
361
Az első képen az 5,6,7 a feladat, a második képen pedig a 4,5,6.
Előre is köszönöm a segítséget!!
Előre is köszönöm a segítséget!!
Jelenleg 1 felhasználó nézi ezt a kérdést.
0
Középiskola / Kémia
Válaszok
1 kazah
megoldása
kazah
megoldása
5, A halogének számának növekedésével a forráspont nő (a táblázatot mondjuk nem látom, de a következtetést te jobban le tudod vonni).
6.
`C_xH_yCl_z` az összegképlet.
A moláris tömege: 12x+y+35,5z `g/(mol)`
Szén-Hidrogén tömegaránya: 31,85:5.32
A szén:hidrogén mólaránya: `31.85/12`:`5.32/1` = 2,65:5,32 = 1:2 = 3:6
klór:hidrogén tömegaránya: 31,85:5,32
klór:hidrogén mólaránya: `31.85/35.5` : `5.32/1` = 1,77:5,32 = 1:3 = 2:6
Tehát feleannyi szénatom van, mint hidrogénatom és háromszorannyi hidrogénatom, mint klóratom.
`C_(3x)H_(6x)Cl_(2x)`
`M_(C_(3x)H_(6x)Cl_(2x)` = 36x+6x+71x = 113x = 113; x = 1
A halogénvegyület összegképlete: `C_3H_6Cl_2`
7,
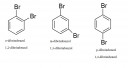
`C_6H_(6-x)Br_x` az összegképlet (Ahány bróm épül be, annyival kevesebb hidrogénatom van a benzolgyűrűn).
`M_(C_6H_(6-x)Br_x` = `12*6+6-x+80x` = 78+79x = 236 `g/(mol)`
x = 2
Három ilyen vegyület lehetséges; 1,2-(o) 1,3-(m) vagy 1,4-(p) helyzetben van a két bróm.
(Csatoltam képet).
Másik lap.
4,
`C_6H_6` + `Br_2` = `C_6H_5Br` + HBr
`M_("benzol")` = 78 `g/(mol)`
`M_(Br_2)` = 159,8 `g/(mol)`
30 g benzol az `30/78` = 0,385 mol
Ez ugyanennyi mol brómmal reagál, ami `0.385*159.8` = 61,46 g
`V_(Br_2)` = `m_(Br_2)/rho_(Br_2)` = `61.46/3.1` = 19,83 `cm^3` bróm szükséges a reakcióhoz.
5,
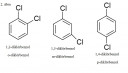
Az összegképlet: `C_6H_(6-x)Cl_x`
Moláris tömege: `6*12+6-x+35.5*x` = `78+36.5x` = 147 `g/(mol)`
x = `(147-78)/35.5` = 2
Mint az előző feladatsorban. (Csatoltam képet, 2. ábra).
7.
Oláh György a karbokationok területén végzett munkásságáért kapta a Nobel-díjat. Ha jól emlékszem (de érdemes utánaolvasnod) a paraffinokat, amik igen ellenálló vegyületek, azokat is képes volt alacsony hőmérsékleten reakcióba vinni, úgymond megprotonálni (azok a karbokationok). Ezek úgynevezett szupersavakkal vagy mágikus savakkal tudta elérni (amik kb `10^6`-szor erősebb savak a kénsavnál), azt hiszem, hogy HF és valamilyen hexafluoro-antimon vegyület volt. Így, mint a krakkolás a szénlánctördelés, egy ellentétes folyamatot, szénláncok összekapcsolását tette lehetővé, gazdaságos magas oktánszámú üzemanyagok előállítása. A karbokationok előállításával a szénatomok öt vegyértékűsége is kissé megingott..
6.
`C_xH_yCl_z` az összegképlet.
A moláris tömege: 12x+y+35,5z `g/(mol)`
Szén-Hidrogén tömegaránya: 31,85:5.32
A szén:hidrogén mólaránya: `31.85/12`:`5.32/1` = 2,65:5,32 = 1:2 = 3:6
klór:hidrogén tömegaránya: 31,85:5,32
klór:hidrogén mólaránya: `31.85/35.5` : `5.32/1` = 1,77:5,32 = 1:3 = 2:6
Tehát feleannyi szénatom van, mint hidrogénatom és háromszorannyi hidrogénatom, mint klóratom.
`C_(3x)H_(6x)Cl_(2x)`
`M_(C_(3x)H_(6x)Cl_(2x)` = 36x+6x+71x = 113x = 113; x = 1
A halogénvegyület összegképlete: `C_3H_6Cl_2`
7,
`C_6H_(6-x)Br_x` az összegképlet (Ahány bróm épül be, annyival kevesebb hidrogénatom van a benzolgyűrűn).
`M_(C_6H_(6-x)Br_x` = `12*6+6-x+80x` = 78+79x = 236 `g/(mol)`
x = 2
Három ilyen vegyület lehetséges; 1,2-(o) 1,3-(m) vagy 1,4-(p) helyzetben van a két bróm.
(Csatoltam képet).
Másik lap.
4,
`C_6H_6` + `Br_2` = `C_6H_5Br` + HBr
`M_("benzol")` = 78 `g/(mol)`
`M_(Br_2)` = 159,8 `g/(mol)`
30 g benzol az `30/78` = 0,385 mol
Ez ugyanennyi mol brómmal reagál, ami `0.385*159.8` = 61,46 g
`V_(Br_2)` = `m_(Br_2)/rho_(Br_2)` = `61.46/3.1` = 19,83 `cm^3` bróm szükséges a reakcióhoz.
5,
Az összegképlet: `C_6H_(6-x)Cl_x`
Moláris tömege: `6*12+6-x+35.5*x` = `78+36.5x` = 147 `g/(mol)`
x = `(147-78)/35.5` = 2
Mint az előző feladatsorban. (Csatoltam képet, 2. ábra).
7.
Oláh György a karbokationok területén végzett munkásságáért kapta a Nobel-díjat. Ha jól emlékszem (de érdemes utánaolvasnod) a paraffinokat, amik igen ellenálló vegyületek, azokat is képes volt alacsony hőmérsékleten reakcióba vinni, úgymond megprotonálni (azok a karbokationok). Ezek úgynevezett szupersavakkal vagy mágikus savakkal tudta elérni (amik kb `10^6`-szor erősebb savak a kénsavnál), azt hiszem, hogy HF és valamilyen hexafluoro-antimon vegyület volt. Így, mint a krakkolás a szénlánctördelés, egy ellentétes folyamatot, szénláncok összekapcsolását tette lehetővé, gazdaságos magas oktánszámú üzemanyagok előállítása. A karbokationok előállításával a szénatomok öt vegyértékűsége is kissé megingott..
1
- Még nem érkezett komment!