Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Kémia házi
 Andi11
kérdése
Andi11
kérdése
274
Szeretnék segítséget kérni.
Jelenleg 1 felhasználó nézi ezt a kérdést.
0
Középiskola / Kémia
Válaszok
1 Skam
válasza
Skam
válasza
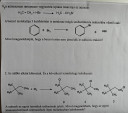
Látszik, hogy a benzol nem egy hagyományos alkén mint az 1. példában látott etén.
A benzolban úgynevezett delokalizált π-elektronfelhő van, ami a 3 konjugált pí kötésből tevődik össze. Egy átlagos ciklikus vegyületnél stabilabb állapotot feltételez a megléte, ez a stabilitás az ún. rezonanciaenergia.
Ettől kevésbé reaktív, így ha egy elektrofil (elektronkedvelő) ágens (támadó vegyület/hatóanyag) mint a bróm (Br - !! ), és elveszítené a delokalizációját egy addíció során, akkor lényegesebben instabilabb lenne mintha nem.
Ugye minden vegyület törekszik a legstabilabb állapot elérésére, ez az energiaminimum-elve.
Ezért történik EAS, electrophilic aromatic substitution (elektrofil aromás szubsztitúció).
Ennek a lépései --> Először nukleofilként (proton kedvelő, elektronhiány kedvelő) viselkedik a benzol, és a támadó brómot beköti datív módon a pí kötésével. Ez mit okoz?
Lesz egy nettó pozitív töltése a benzolnak, ami instabil, több rezonanciaszerkezettel bír, mert csúszkál a maradék 2 db pí kötése.
Ezek után a hidrogén ami ugyanarra a szénatomra köt mint a támadó leszakad mert a másik Br - ion letépi azt. Ezzel rearomatizál és stabilizálódik a gyűrű. Újra 3 pí kötése lesz, delokalizált és rajta maradt a bróm.
Általában katalizátorok segítségével történik mint pl: a FeBr3
Neked annyi a fontos, hogy energetikailag kedvezőtlen az addíció mert elveszíti a stabil szerkezetét, de megpróbáltam elmagyarázni a mechanizmusát a jobb megértés érdekében (valószínűleg ezt nem kell tudnod, de ad egy képet a okokról)
Ha van kérdésed nyugodtan írj!!
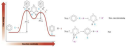
csatoltam egy képet
A benzolban úgynevezett delokalizált π-elektronfelhő van, ami a 3 konjugált pí kötésből tevődik össze. Egy átlagos ciklikus vegyületnél stabilabb állapotot feltételez a megléte, ez a stabilitás az ún. rezonanciaenergia.
Ettől kevésbé reaktív, így ha egy elektrofil (elektronkedvelő) ágens (támadó vegyület/hatóanyag) mint a bróm (Br - !! ), és elveszítené a delokalizációját egy addíció során, akkor lényegesebben instabilabb lenne mintha nem.
Ugye minden vegyület törekszik a legstabilabb állapot elérésére, ez az energiaminimum-elve.
Ezért történik EAS, electrophilic aromatic substitution (elektrofil aromás szubsztitúció).
Ennek a lépései --> Először nukleofilként (proton kedvelő, elektronhiány kedvelő) viselkedik a benzol, és a támadó brómot beköti datív módon a pí kötésével. Ez mit okoz?
Lesz egy nettó pozitív töltése a benzolnak, ami instabil, több rezonanciaszerkezettel bír, mert csúszkál a maradék 2 db pí kötése.
Ezek után a hidrogén ami ugyanarra a szénatomra köt mint a támadó leszakad mert a másik Br - ion letépi azt. Ezzel rearomatizál és stabilizálódik a gyűrű. Újra 3 pí kötése lesz, delokalizált és rajta maradt a bróm.
Általában katalizátorok segítségével történik mint pl: a FeBr3
Neked annyi a fontos, hogy energetikailag kedvezőtlen az addíció mert elveszíti a stabil szerkezetét, de megpróbáltam elmagyarázni a mechanizmusát a jobb megértés érdekében (valószínűleg ezt nem kell tudnod, de ad egy képet a okokról)
Ha van kérdésed nyugodtan írj!!
csatoltam egy képet
Módosítva: 11 hónapja
0
- Még nem érkezett komment!