Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
1:1 térfogatarányban összekevert metán-vízgőz egyenletet 1200 C-ra hevítve CH4+H2O<->CO+3H2O Mi a keletkező gázelegy v/v%-os összetétele és hány mol molekulát tartalmaz 1 dm3 egyensúlyi elegy?
 marchello
kérdése
marchello
kérdése
451
+ CH4, H2O átalakulásának mértéke?
A folyamat egyensúlyi állandója K = 0,255
Az egyenlet szerint az egyensúlyig 1,5 szeres anyagmennyiség-növekedést tapasztalunk.
Le tudná nekem vezetni valaki ezt a feladatot?
Sajnos a tankönyv és az interneten más oldalakon talált megoldásokat nem értem.
Köszönöm!
A folyamat egyensúlyi állandója K = 0,255
Az egyenlet szerint az egyensúlyig 1,5 szeres anyagmennyiség-növekedést tapasztalunk.
Le tudná nekem vezetni valaki ezt a feladatot?
Sajnos a tankönyv és az interneten más oldalakon talált megoldásokat nem értem.
Köszönöm!
Jelenleg 1 felhasználó nézi ezt a kérdést.
egyensúlyirendszerek
egyensúlyirendszerek
0
Középiskola / Kémia
Válaszok
1 kazah
megoldása
kazah
megoldása
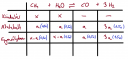
Lerajzolod a szokásos táblázatot.
Kiindulunk x mol metánból, ugyanennyi vízből.
Átalakul 'a' mol. A hidrogénből '3a' mol keletkezik.
Az egyensúlyi elegyben van:
x-a mol metán, x-a mol vízgőz, a mol CO és 3a mol hidrogén, ez összesen:
`(x-a)+(x-a)+a+3a` = `2x+2a`
A kiindulási anyagmennyiséghez képest (ami 2x mol) másfélszerese.
`(2x+2a)/(2x)=1.5`
2x+2a=3x
a = `x/2` (ezt már kékkel behelyettesítettem a táblázatba).
Az átalakulás mértéke tehát `a/x` = `1/2` (50 %)
A térfogat%-os összetétel:
Az összmólok száma:
`0.5x+0.5x+0.5x+1.5x=3x`
`CH_4`, `H_2O`, `CO` : `(0.5x)/(3x)` = `1/6`, tehát `16.dot(6)` %
`H_2`: `(1.5x)/(3x)` = `1/2` , vagyis 50 %.
Felírhatjuk az egyensúlyi állandót:
`K=([CO]*[H_2]^3)/([CH_4]*[H_2O])`
`0.255 =(0.5x*(1.5x)^3)/(0.5x*0.5x)`
`0.255=6,75x^2`
`x=root()(0.255/6.75)` = 0,194 `(mol)/(dm^3)`
Ennyi metánból és vízgőzből indultunk ki.
Az összmólok száma `dm^3`-enként:
`3x=3*0.194` = 0,583 mol.
Kiindulunk x mol metánból, ugyanennyi vízből.
Átalakul 'a' mol. A hidrogénből '3a' mol keletkezik.
Az egyensúlyi elegyben van:
x-a mol metán, x-a mol vízgőz, a mol CO és 3a mol hidrogén, ez összesen:
`(x-a)+(x-a)+a+3a` = `2x+2a`
A kiindulási anyagmennyiséghez képest (ami 2x mol) másfélszerese.
`(2x+2a)/(2x)=1.5`
2x+2a=3x
a = `x/2` (ezt már kékkel behelyettesítettem a táblázatba).
Az átalakulás mértéke tehát `a/x` = `1/2` (50 %)
A térfogat%-os összetétel:
Az összmólok száma:
`0.5x+0.5x+0.5x+1.5x=3x`
`CH_4`, `H_2O`, `CO` : `(0.5x)/(3x)` = `1/6`, tehát `16.dot(6)` %
`H_2`: `(1.5x)/(3x)` = `1/2` , vagyis 50 %.
Felírhatjuk az egyensúlyi állandót:
`K=([CO]*[H_2]^3)/([CH_4]*[H_2O])`
`0.255 =(0.5x*(1.5x)^3)/(0.5x*0.5x)`
`0.255=6,75x^2`
`x=root()(0.255/6.75)` = 0,194 `(mol)/(dm^3)`
Ennyi metánból és vízgőzből indultunk ki.
Az összmólok száma `dm^3`-enként:
`3x=3*0.194` = 0,583 mol.
1
-
marchello: Így már teljesen érthető, köszönöm szépen! 3 éve 0
-
kazah: Nagyon szívesen! 3 éve 0