Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
300 C-on az ammónia disszociál...
 marchello
kérdése
marchello
kérdése
704
a gázelegy átlagos moláris tömege egyensúlyban 12,92 g/mol. Az egyensúlyi elegyben a molekulák összkoncentrációja 2,13 mol/dm3. Az ammónia hány %-ka disszociál?
2 NH₃ ⇔ N₂(g) + 3 H₂(g)
b, Mekkora ezen a hőmérsékleten az egyensúlyi állandó értéke?
Kérlek, valaki vezesse le nekem ezt a feladatot.
Köszönöm szépen!
2 NH₃ ⇔ N₂(g) + 3 H₂(g)
b, Mekkora ezen a hőmérsékleten az egyensúlyi állandó értéke?
Kérlek, valaki vezesse le nekem ezt a feladatot.
Köszönöm szépen!
Jelenleg 1 felhasználó nézi ezt a kérdést.
egyensúlyok
egyensúlyok
1
Középiskola / Kémia
Válaszok
1 kazah
megoldása
kazah
megoldása
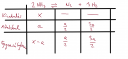
Ez egy általános táblázat (lent); kiindulás, átalakul, egyensúlyban.
Kiindultunk x mol ammóniából.
Átalakult a mol ammónia, az egyenletnek megfelelően keletkezett `a/2` mol nitrogén és `(3a)/2` mol hidrogén.
Az egyensúlyi elegyben van x-a mol ammónia, `a/2` mol hidrogén és `(3a)/2` mol hidrogén.
Az összmólok száma `x-a+a/2+(3a)/2` = x+a = 2,13 mol. (Ha 1 `dm^3`-nek vesszük a térfogatot).
A moláris tömegre vonatkozó összefüggés: (az a-t már kifejezzük; a=2,13-x)
`M_("elegy")` = `(M_(H_2)*c_(H_2)+M_(N_2)*c_(N_2)+M_(NH_3)*c_(NH_3))/(c_ö)`
`12.92=(2*3*(2.13-x)/2+28*(2.13-x)/2+17*(x-(2.13-x)))/2.13`
x = 1,62
a = 2,13-1,62 = 0,51
A disszociációfok:
`a/x` = `0.51/1.62` = 0,315 , vagyis `ul("31,5 %")`-os a disszociáció.
`[H_2]` = `(3a)/2` = 0,765 `(mol)/(dm^3)`
`[N_2]` = `a/2` = 0,255 `(mol)/(dm^3)`
`[NH_3]` = `x-a` = 1,62-0,51 = 1,11 `(mol)/(dm^3)`
`K=([N_2]*[H_2]^3)/([NH_3]^2)` = `(0.255*0.765^3)/1.11^2` = 0,093 `((mol)/(dm^3))^2`
Kiindultunk x mol ammóniából.
Átalakult a mol ammónia, az egyenletnek megfelelően keletkezett `a/2` mol nitrogén és `(3a)/2` mol hidrogén.
Az egyensúlyi elegyben van x-a mol ammónia, `a/2` mol hidrogén és `(3a)/2` mol hidrogén.
Az összmólok száma `x-a+a/2+(3a)/2` = x+a = 2,13 mol. (Ha 1 `dm^3`-nek vesszük a térfogatot).
A moláris tömegre vonatkozó összefüggés: (az a-t már kifejezzük; a=2,13-x)
`M_("elegy")` = `(M_(H_2)*c_(H_2)+M_(N_2)*c_(N_2)+M_(NH_3)*c_(NH_3))/(c_ö)`
`12.92=(2*3*(2.13-x)/2+28*(2.13-x)/2+17*(x-(2.13-x)))/2.13`
x = 1,62
a = 2,13-1,62 = 0,51
A disszociációfok:
`a/x` = `0.51/1.62` = 0,315 , vagyis `ul("31,5 %")`-os a disszociáció.
`[H_2]` = `(3a)/2` = 0,765 `(mol)/(dm^3)`
`[N_2]` = `a/2` = 0,255 `(mol)/(dm^3)`
`[NH_3]` = `x-a` = 1,62-0,51 = 1,11 `(mol)/(dm^3)`
`K=([N_2]*[H_2]^3)/([NH_3]^2)` = `(0.255*0.765^3)/1.11^2` = 0,093 `((mol)/(dm^3))^2`
1
-
marchello: Köszönöm szépen a segítséget! 3 éve 0
-
kazah: Nagyon szívesen! 3 éve 1