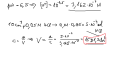Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Hány dm3 víz szükséges 6,50-ös pH-jú oldathoz, ha 10 cm3 0, 050 mol/dm3-es sósav áll a rendelkezésünkre?
 marchello
kérdése
marchello
kérdése
328
A fenti feladatban szeretnék segítséget kérni.
Örömmel venném, ha valaki levezetné a megoldást.
Köszönöm!
Örömmel venném, ha valaki levezetné a megoldást.
Köszönöm!
Jelenleg 1 felhasználó nézi ezt a kérdést.
pH
pH
0
Középiskola / Kémia
Válaszok
2 rolandstefan
{ Vegyész }
válasza
rolandstefan
{ Vegyész }
válasza
Szia,
csatoltam képet
a válasz: 1581.3 köbdeci víz kell (igazából ez az oldat mennyisége, de azt a 10 köbcentit elhanyagoltam), feltételeztem, mivel nem adnak meg a kiindulási oldatra nézve sűrűséget, meg semmi egyebet, így az abban levő víz mennyisége elhanyagolható.
Esetleg kérdésed van, nyugodtan írj!
csatoltam képet
a válasz: 1581.3 köbdeci víz kell (igazából ez az oldat mennyisége, de azt a 10 köbcentit elhanyagoltam), feltételeztem, mivel nem adnak meg a kiindulási oldatra nézve sűrűséget, meg semmi egyebet, így az abban levő víz mennyisége elhanyagolható.
Esetleg kérdésed van, nyugodtan írj!
0
-
marchello: Először én is így próbálkoztam, de sajnos nem ez lett a megoldás. 3 éve 0
-
rolandstefan: ha nem középiskola kategóriába rakod én is úgy csinálom, mint kazah, középsulis szinten nem kell az amit kazah leírt 3 éve 0
-
marchello: Ez a feladat egy középiskolai példatárban van. 3 éve 0
-
marchello: Ettől függetlenül köszönöm a megoldást és a levezetést is! 3 éve 0
 kazah
megoldása
kazah
megoldása
pH = 6,5 `rightarrow` `[H^+]=10^(-6.5)`
A hidrogénion-koncentráció ilyen híg oldatoknál két anyagból származik:
1. A HCl teljes disszociációjából (ez lesz x);
2. A víz öndisszociációjából.
A meghatározzuk a hidroxidion-koncentrációt:
`[OH^-]` = `K_v/[H^+]` = `10^(-14)/10^(-6.5)` = `10^(-7.5)`
A vízben ugyanennyi a hidrogénion-koncentráció.
A vízionszorzat az alábbi módon tevődik össze:
`K_v=[H^+]*[OH^-]=(10^(-7.5)+x)*10^(-7.5)=10^(-14)`
`x=10^(-14)/10^(-7.5)-10^(-7.5)` = `2.846*10^(-7)`
Ilyen koncentrációjú lett az oldal HCl-ra nézve.
A koncentrációk aránya a hígítás aránya:
`0.05/(2.84*10^(-7))=y/10` (y a végső oldat térfogata)
y = `1.757*10^6` `cm^3` = 1757 `dm^3` (a 10 `cm^3`-t ugyanúgy elhanyagolhatjuk).
A hidrogénion-koncentráció ilyen híg oldatoknál két anyagból származik:
1. A HCl teljes disszociációjából (ez lesz x);
2. A víz öndisszociációjából.
A meghatározzuk a hidroxidion-koncentrációt:
`[OH^-]` = `K_v/[H^+]` = `10^(-14)/10^(-6.5)` = `10^(-7.5)`
A vízben ugyanennyi a hidrogénion-koncentráció.
A vízionszorzat az alábbi módon tevődik össze:
`K_v=[H^+]*[OH^-]=(10^(-7.5)+x)*10^(-7.5)=10^(-14)`
`x=10^(-14)/10^(-7.5)-10^(-7.5)` = `2.846*10^(-7)`
Ilyen koncentrációjú lett az oldal HCl-ra nézve.
A koncentrációk aránya a hígítás aránya:
`0.05/(2.84*10^(-7))=y/10` (y a végső oldat térfogata)
y = `1.757*10^6` `cm^3` = 1757 `dm^3` (a 10 `cm^3`-t ugyanúgy elhanyagolhatjuk).
1
-
marchello: Köszönöm szépen, minden világos! 3 éve 0