Toplista

- betöltés...
Ha szívesen korrepetálnál, hozd létre magántanár profilodat itt.
Ha diák vagy és korrepetálásra van szükséged, akkor regisztrálj be és írd meg itt, hogy milyen tantárgyban!
Hány gramm nitrozil-bromidot kell 10 dm3-es zárt edénybe tenni, hogy 240 C-on éppen 1 mol brómot tartalmazzon az egyensúlyi elegy?
 marchello
kérdése
marchello
kérdése
462
Hány gramm nitrozil-bromidot kell 10 dm3-es zárt edénybe tenni, hogy 240 C-on éppen 1 mol brómot tartalmazzon az egyensúlyi elegy?
Valaki esetleg le tudná ezt vezetni nekem részletesen? Sajnos az interneten és a könyvben található megoldásokat nem igazán értem.
Köszönöm!
Valaki esetleg le tudná ezt vezetni nekem részletesen? Sajnos az interneten és a könyvben található megoldásokat nem igazán értem.
Köszönöm!
Jelenleg 1 felhasználó nézi ezt a kérdést.
kémia
kémia
0
Középiskola / Kémia
Válaszok
1 kazah
megoldása
kazah
megoldása
Az egyensúlyi állandót nem lett volna hátrány, ha megadod, mert anélkül nem fog menni.
K=0,72-t találtam, reméljük ennyi (az adott folyamatra és hőmérsékleten)
Nem tudom, hogy mennyire menjünk vissza az ilyen feladatok megoldásához. Tehát ez egy egyensúlyi folyamat. Bemértünk a 10 literes edénybe valamennyi nitrozil-bromidot, lezártuk, megmelengettük és az egyensúly beállta után keletkezett 1 mol bróm.
A rendszerben a bróm egyensúlyi koncentrációja tehát 1 mol/10 `"dm"^3` = 0,1 `("mol")/("dm"^3)`.
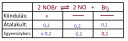
Mellékeltem egy táblázatot, amit érdemes használni az ilyen egyensúlyi folyamatoknál, sokat segít.
Kiindulás: Amit bemértünk, csak a nitrozil-bromid, ez a kérdés, ezt jelöljük x-szel.
Az átalakult mennyiséget tudjuk következtetni az egyensúlyi bróm mennyiségéből (koncentrációjából). Amennyi bróm keletkezett, kétszerannyi nitrogén-monoxid keletkezett és ugyanennyi alakult át. Az átalakult nitrozil-bromid mennyisége tehát a reakcióegyenlet szerint egyenlő a keletkezett nitrogén-oxid mennyiségével.
Az egyensúlyi elegyben (1 `dm^3`-ben, így már koncentrációval tudunk számolni) van 0,1 mol bróm; 0,2 mol NO és x-0,2 mol `NOBr`.
Felírjuk az egyensúlyi állandót:
K = `([NO]^2[Br_2])/([NOBr]^2)`
`0.72=(0.2^2*0.1)/(x-0.2)^2`
Ezt megoldod x-re. Két gyököt kapsz, igaz, hogy mindkettő pozitív, de ami 0,2-nél kisebb, az nem jöhet számításba, hiszen abból nem fogyhatott 0,2 mol.
x = `c_(NOBr)` = 0,2745 `(mol)/(dm^3)`.
Nekünk 10 literes a tartályunk, a NOBr mennyisége tehát tízszerennyi, vagyis 2,745 mol, ami `2.745*109.9` = `ul(color(red)("301,74 g"))` a bemért nitrozil-bromid mennyisége.
K=0,72-t találtam, reméljük ennyi (az adott folyamatra és hőmérsékleten)
Nem tudom, hogy mennyire menjünk vissza az ilyen feladatok megoldásához. Tehát ez egy egyensúlyi folyamat. Bemértünk a 10 literes edénybe valamennyi nitrozil-bromidot, lezártuk, megmelengettük és az egyensúly beállta után keletkezett 1 mol bróm.
A rendszerben a bróm egyensúlyi koncentrációja tehát 1 mol/10 `"dm"^3` = 0,1 `("mol")/("dm"^3)`.
Mellékeltem egy táblázatot, amit érdemes használni az ilyen egyensúlyi folyamatoknál, sokat segít.
Kiindulás: Amit bemértünk, csak a nitrozil-bromid, ez a kérdés, ezt jelöljük x-szel.
Az átalakult mennyiséget tudjuk következtetni az egyensúlyi bróm mennyiségéből (koncentrációjából). Amennyi bróm keletkezett, kétszerannyi nitrogén-monoxid keletkezett és ugyanennyi alakult át. Az átalakult nitrozil-bromid mennyisége tehát a reakcióegyenlet szerint egyenlő a keletkezett nitrogén-oxid mennyiségével.
Az egyensúlyi elegyben (1 `dm^3`-ben, így már koncentrációval tudunk számolni) van 0,1 mol bróm; 0,2 mol NO és x-0,2 mol `NOBr`.
Felírjuk az egyensúlyi állandót:
K = `([NO]^2[Br_2])/([NOBr]^2)`
`0.72=(0.2^2*0.1)/(x-0.2)^2`
Ezt megoldod x-re. Két gyököt kapsz, igaz, hogy mindkettő pozitív, de ami 0,2-nél kisebb, az nem jöhet számításba, hiszen abból nem fogyhatott 0,2 mol.
x = `c_(NOBr)` = 0,2745 `(mol)/(dm^3)`.
Nekünk 10 literes a tartályunk, a NOBr mennyisége tehát tízszerennyi, vagyis 2,745 mol, ami `2.745*109.9` = `ul(color(red)("301,74 g"))` a bemért nitrozil-bromid mennyisége.
1
-
marchello: Köszönöm szépen, nagyon szuper! így már látom, hogy hol akadtam el!
 3 éve
0
3 éve
0
-
Ármós Csaba: Én is köszönöm, hogy megoldottad helyettem, Kazah! Lebetegedtem, csak feküdni tudok, ugyanis becsípődött a derekam. :( 3 éve 0